Métodos de Separación
1.- Tamizado.
Se emplea para la separación de sólidos y dependiendo del tamaño es la perforación de la malla.

2.- Flotación.
Método empleado para separar algunos minerales.
Con la ayuda de la atención superficial se pueden separar estos componentes.

3.- Arrastre con agua.
Metodo empleado para eliminar un mineral solubles de uno insoluble.

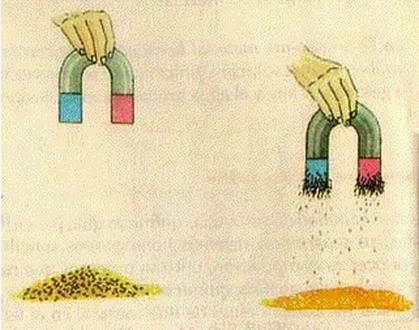
4.- Magnetismo.
Con este metodo se separan los elementos por medio de un campo magnetico, utilizando un magneto o un electro iman.
5.- Sublimación
Este método se aplica cuando alguno de los componentes pasa directamente de solido a gas y se aprovechan las impurezas que no son utilizadas.

6.- Sedimentacion
Se emplea en la separacion de mezclas heterogéneas formadas por sólidos que estan suspendidos en liquido.

7.- Filtración
Se emplea para separar el liquido del solido mediante el uso de un filtro y obtener liquido puro.
8.- Centrifugacion.
Una mezcla de líquidos o de sólidos o de ambos se va a someter a un movimiento giratorio que es muy rápido (revoluciones por minuto) y va ayudar a separar las mezclas.
9.- Cristalización
Se aplica para separar sólidos disueltos en liquido donde se evapora rápidamente el liquido y el solido se presenta en cristales.

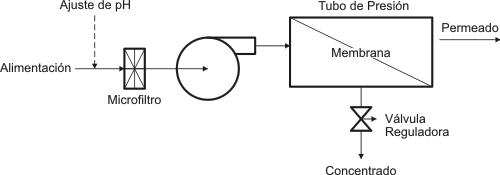
10.- Ósmosis inversa
Es un fenómeno en el cual el disolvente atraviesa las paredes de una membrana osmótica y ayuda a separar líquidos que tienen diferentes concentraciones.
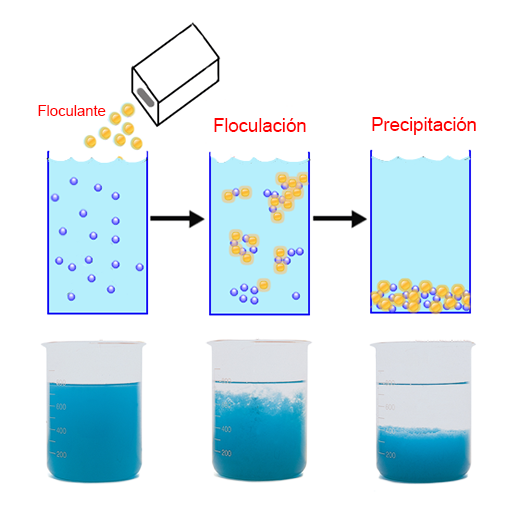
11.- Floculacion
Este método se utiliza para destruir un coloide.
Se utiliza principalmente para el tratado de aguas residuales.
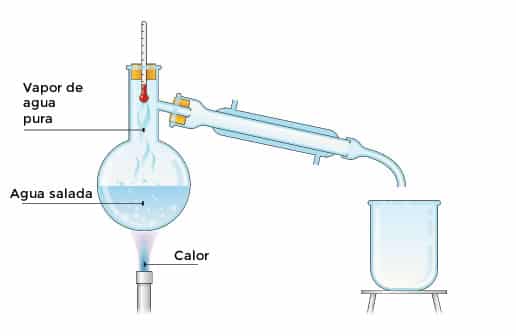
12.- Destilación
Es el proceso en el cual separa un disolvente de una mezcla liquida, poniéndola a hervir.
Se pone a hervir y luego se condensan los vapores, se calienta el liquido hasta que haya evaporación.
¿Tienes alguna duda de esto?
Te recomendamos ver este vídeo donde podrás aclarar tus ultimas dudas.
A llegado el momento de algunos "sabias que".
¿Sabías qué?
Que la regla de Hund fue formulada por primera vez en el año 1925.

¿Sabias que?
Los hidruros son moléculas que poseen un No metal o Metal, unido a un átomo de hidrógeno

¿Sabias que?
Que a los óxidos No Metales también se les llama óxidos ácidos o anhidridos

¿Sabias que?
Que las PPM se relaciónan con los miligramos qué hay en un kilogramos de una disolución, que también se disuelven en 1 litro de solvente

¿Sabias que?
El pH se mide en una escala de 0-14 , el 7 es neutro , de 0 a 6.9 es ácida y de 7.1 a 14 es básica

¿Sabias que?
Las configuraciones electrónicas muestran el acomodo de electrones en el átomo

¿Sabias que?
La cantidad de numeroso cuánticos es de 4

¿Sabias que?
Un orbital atómico es la región del espacio definido por una determinada solución particular, espacial e independiente del tiempo.

¿Sabias que?
Que en el primer orbital todos los átomos trabajan con dos, excepto el Hidrógeno.
¿Sabias que?
La diferencia entre el número de valencia y oxidación, es que el número de valencia de un elemento determina el número de electrones que tiene en su último nivel de energía y el número de oxidación es el que nos dice el número de electrones que un átomo recibe o que pone a disposición de otros.
¿tienes alguna duda sobre el tema de "nomenclatura"?
Aquí te dejamos una ayuda.
Nomenclatura inorgánica.
*Nomenclatura de stocke:
Esta nomenclatura tiene en cuenta los valores de los estados
de oxidación positivos; (es decir, elementos metálicos).
Se representan con números romanos encerrados entre paréntesis.
Ejemplos:
I2O = óxido de yodo (I)
I2O3 = óxido de yodo (III)
I2O5 = óxido de yodo (V)
I2O7 = óxido de yodo (VII)
KOH = hidróxido de potasio (I)
Ca(OH)2 = hidróxido de potasio (II)
Al(OH)3 = hidróxido de aluminio (III)
*Nomenclatura del sistema IUPAC:
Se basa en nombrar a la sustancia, usado prefijos, números griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula.
La forma de nombrar los compuestos en este sistema es:
Prefijo – nombre genérico + nombre específico.
Ejemplos:
CrBr3 = tribromo de cromo.
CO = monóxido de carbono.
CO2 = bióxido de carbono.
SO3 = trioxido de azufre.
PO4 = tetraoxido de fósforo.
Nomenclatura de:
•Hidruros: molécula que posee un NO METAL o METAL, unido a un átomo de hidrógeno.
•Óxidos no metálicos:
-También llamados óxidos ácidos o anhídridos.
-Unión de un NO METAL + OXÍGENO.
Ejemplos:
Cl: +1, +3, +5, +7 = +1 hipocloroso.
+3 cloroso.
+5 clorico.
+7 perclorico.
Br: +1, +3, +5 = +1 hipobromoso.
+3 bromoso.
+5 bromico.
C: +2, +4 = +2 carbonoso.
+4 carbónico.
At: +1, +3, +5, +7 = +1 Hipoastatoso.
+3 astatoso.
+5 astatoico.
+7 perastatoico.
•Oxácidos:
Compuestos formados por un no metal, oxígeno e hidrógeno. Se obtienen a partir del óxido ácido o anhídrido, sumándole H2O.
Ejemplos:
SO3 + H2O = H2SO4
CrO3 + H2O = H2CRO4
PARA RESOLVER ESTE TIPO DE EJERCICIOS PRIMERO SE PONE EL NÚMERO DE HIDROGENOS, EL NÚMERO DE ELEMENTOS QUE SE TENGA Y NÚMERO DE OXIGENOS.
•Sales binarias:
Surgen de la sustitución del hidrógeno de los hidrácidos por un metal, por lo que se puede expresar:
Metal + No metal.
✓Primero se nombra el no metal (derecha) con terminación “URO”.
✓ Después se nombra el metal (izquierda).
Ejemplos:
NaCl = cloruro de sodio
KBr = bromuro de potasio
Cal2 = Yoduro de calcio.
AlF3 = Floruro de aluminio.
•Oxisales:
Metal + Radical.
PO3 (Fosfito) MnO4 (Permanganato) NO3 (Nitrato) SO4 (Sulfato) PO4 (Fosfato)
CO4 (Carbonato) ClO4 (Perclorato)
Ejemplos:
CaSO4 = sulfato de calcio
KMnO4 = permanganato de potasio
BaCO3 = carbonato de bario
AlPO3 = fosfito de aluminio
• Hidracidos:
Son combinaciones de átomos de hidrógeno + halógenos (VIIA)
Sufijo ácido + elemento no metálico – terminación hídrico
Ejemplos:
HF = ácido flour hídrico
HCl = ácido clorhídrico
HBr = ácido brohidrico
HI = ácido yodhídrico

Muy bien equipo!!!
ResponderEliminarLos felicito, me gustó mucho su diseño. Tienen 2.0